- A+
分享一篇发表在Nat. Chem. Biol.上的文章,题目为“Reversible histone deacetylase activity catalyzes lysine acylation”,通讯作者是来自加州大学旧金山分校的Emily L. Goldberg教授,她的研究方向聚焦于免疫与代谢的串扰。这篇文章中,作者发现I类组蛋白脱乙酰酶(HDAC)可以催化蛋白质赖氨酸β-羟基丁酰化(Kbhb)的形成。

蛋白质赖氨酸β-羟基丁酰化(Kbhb)是近期发现的新型蛋白质翻译后修饰,虽然Kbhb被认为是通过β-羟基丁酰CoA为中间体产生的,但几种组蛋白酰基转移酶对β-羟基丁酰CoA的活性非常低,并且β-羟基丁酰CoA水平也比其他酰基CoA低几个数量级。考虑到Kbhb在细胞和组织中的广泛分布,作者推断可能存在其他途径调控Kbhb。
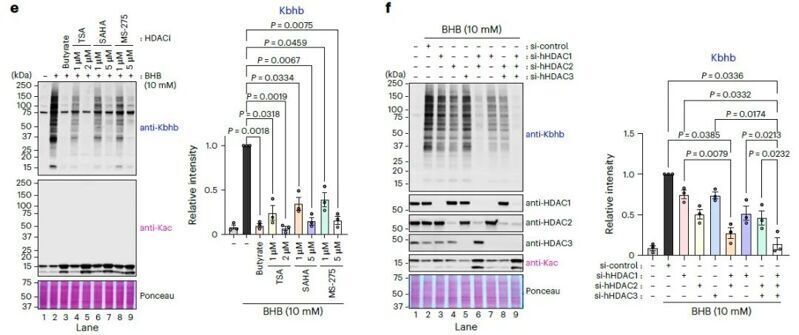
于是作者首先利用pan-Kbhb抗体对BHB处理的细胞进行免疫沉淀,发现HDAC1和HDAC2及其已知的结合蛋白在Kbhb蛋白质组中显著富集。随后通过HDAC抑制剂和siRNA敲低的方式,作者发现HDAC1、HDAC2和HDAC3的活性降低会抑制Kbhb的形成。
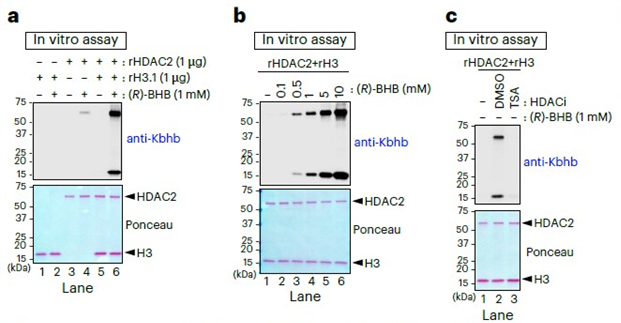
随后,作者通过重组蛋白的体外反应,确定HDAC2可以直接利用β-羟基丁酸催化组蛋白H3上的Kbhb形成。进一步作者发现HDAC1和HDAC3也具有相同的活性,并且HDAC2还可以催化形成其他短链脂肪酸的酰基化修饰,如乳酰化、丁酰化、丙酰化和乙酰化。而添加游离CoA会抑制修饰的形成,说明HDAC催化的酰基化不需要CoA或CoA衍生物。
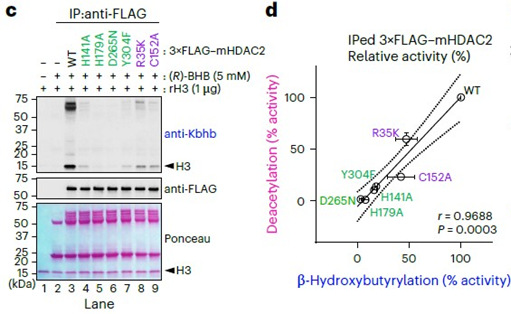
接着作者希望确定HDAC2催化Kbhb的分子机制。作者基于此前针对脱乙酰化关键残基的研究,在细胞中敲除HDAC2并回补其单点突变体,通过体外反应检测HDAC2突变体的β-羟基丁酰化活性和脱乙酰化活性,结果显示HDAC2脱乙酰化结构域内的活性位点也参与Kbhb的形成。
最后,作者使用HDAC抑制剂帕比司他处理禁食小鼠模型,发现脾脏和骨髓等非生酮器官中Kbhb受到抑制而Kac增加,说明在哺乳动物生理条件下存在HDAC催化形成Kbhb。
总之,这篇文章中作者证明HDAC可以反向催化蛋白质形成酰基化修饰,解释了这类翻译后修饰的新调节机制。
本文作者:LCX
责任编辑:LZ
DOI:10.1038/s41589-025-01869-5
原文链接:https://doi.org/10.1038/s41589-025-01869-5


目前评论: