- A+
核苷的合成涉及亲核的杂环碱与亲电子糖的偶联。甲硅烷基 - 希尔伯特 - 约翰逊(或Vorbrüggen)反应在路易斯酸存在下使用甲硅烷基化的杂环碱和亲电子糖衍生物,是以这种方式形成核苷的最常用方法。
介绍
核苷通常通过亲核嘧啶,嘌呤或其他碱性杂环与核酸或脱氧核糖的衍生物偶联而合成,所述核糖或脱氧核糖的衍生物在异头碳上是亲电子的。当使用酰基保护的核糖时,选择性形成β-核苷(在异头碳上具有S构型)是由邻近的基团参与引起的。直接从脱氧核糖衍生物中立体选择性合成脱氧核糖核苷更难以实现,因为不能进行邻近的基团参与。
已经使用三种通用方法从亲核碱和亲电子糖合成核苷。在融合方法涉及加热基和乙酰基保护的1-acetoxyribose至155℃,并导致形成核苷的具有70%的最大产率。[2]
(1)

该金属盐的方法包括用一种保护的糖卤化物杂环的金属盐的组合。最初使用银[3]和汞[4]盐; 然而,最近开发的方法使用钠盐。[5]
(2)

所述甲硅烷基-希尔伯特-约翰逊(SHJ)的反应(或反应Vorbrüggen),为核苷的形成最温和的一般方法,是甲硅烷基化杂环的在路易斯酸的存在下,组合和保护的糖酯。[6]避免了与杂环碱及其金属盐的不溶性相关的问题; 然而,当使用含有多个碱性位点的杂环时,位点选择性有时是一个问题,因为反应通常是可逆的。
(3)
机制与立体化学
Silyl-Hilbert-Johnson反应
SHJ反应的机理始于关键环状阳离子1的形成。然后发生最亲核氮(N 1)在异头位置的亲核攻击,产生所需的β-核苷2。[7]该核苷与1的第二反应产生双(核糖苷)3。取决于所用路易斯酸的性质,亲核试剂与路易斯酸的配位可能是显着的。该“封闭的”亲核试剂与1的反应导致不希望的组成异构体4,其可以进一步反应3。[8]通常,当使用路易斯酸如三甲基甲硅烷基三氟甲磺酸酯时,路易斯酸配位不是问题。当使用更强的路易斯酸如氯化锡(IV)时,更为重要。[9]
(4)
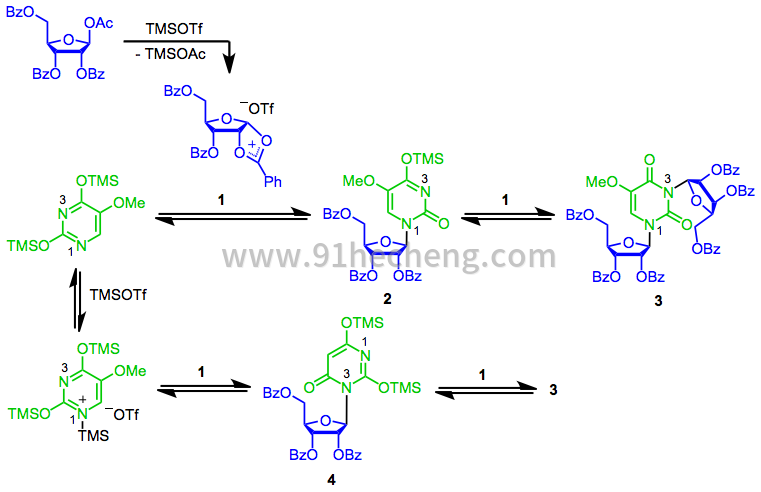
2-Deoxysugars 由于缺少苯甲酰基而不能形成环状阳离子中间体1 ; 相反,在路易斯酸性条件下,它们形成共振稳定的氧代羰基离子。亲核攻击对该中间体的非对映选择性远低于对环状阳离子1的立体选择性。由于这种低立体选择性,通常使用除SHJ反应之外的方法合成脱氧核糖核苷。[10]
范围和限制
甲硅烷基 - 希尔伯特 - 约翰逊反应是从杂环和糖基原料合成核苷的最常用方法。然而,该反应存在一些与其他方法无关的问题,例如在某些情况下不可预测的位点选择性(见下文)。该部分描述了用于合成核苷的SHJ反应的衍生物和替代物。
Silyl-Hilbert-Johnson Reactions
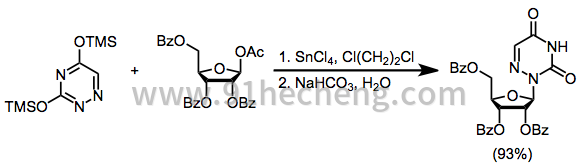
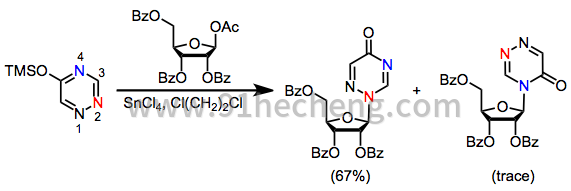
因为大多数杂环碱基含有多个亲核位点,所以位点选择性是核苷合成中的重要问题。例如,嘌呤碱在N 3处动力学反应并在N 1处热力学反应(参见方程(4))。[4]。胸腺嘧啶与受保护的1-乙酰氧基核糖的糖基化产生60%的N 1核苷和23%的N 3核苷。另一方面,密切相关的三嗪以完全选择性反应以提供N 2核苷。[11]
(5)
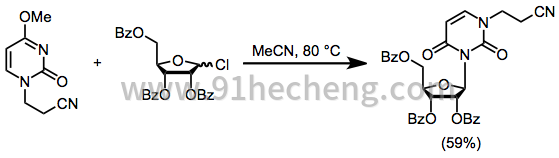
在核苷合成之前,可以通过烷基化来阻断最亲核的氮。加热方程式中的封闭核苷。(6)在受保护的糖氯化物存在下提供的核苷产率为59%。这种类型的反应受到初始烷基氯烷基化杂环的阻碍。[12]
(6)
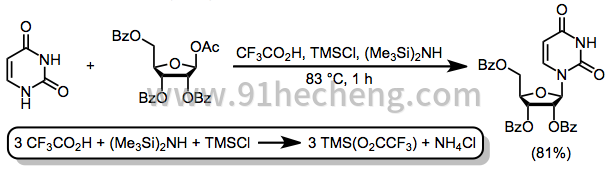
甲硅烷基化的杂环碱易于水解,因此有些难以处理; 因此,开发用于甲硅烷基化和核苷合成的一锅法一步法是一项重大进步。[13]的三氟乙酸(TFA)的组合体,氯化三甲基硅烷(的TMSCl),六甲基二硅和(HMDS)生成三甲基硅烷基三氟乙酸盐在原位,其中完成该杂环的两个甲硅烷基化和其与糖随后的偶联。[14]
(7)
核苷合成的其他方法
涉及糖部分从一个杂环碱基可逆转移到另一个杂环碱基的转糖基作用对于嘧啶核苷转化成嘌呤核苷是有效的。由于平衡核苷之间的热力学差异小,大多数其他转糖基反应是低产率的。[15]
(8)

脱氧核糖衍生的亲电子试剂不能形成环状阳离子1 ; 结果,脱氧核糖核苷的立体选择性合成比核糖核苷的合成更困难。该问题的一个解决方案涉及核糖核苷的合成,然后保护3'-和5'-羟基,通过Barton脱氧除去2'-羟基,并脱保护。[16]
(9)

与其他方法比较
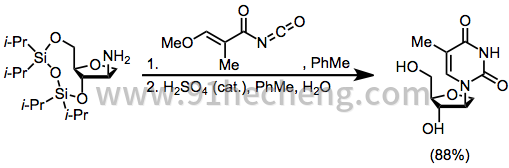
这里描述的避免SHJ反应的位点选择性问题的方法的有用替代方案是串联迈克尔反应/环化以同时形成杂环碱并建立其与糖部分的连接。[17]
(10)
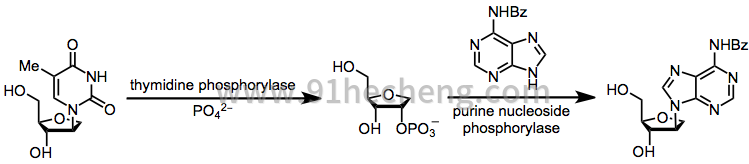
第二种选择是酶促转糖基作用,其完全受动力学控制(避免与热力学控制相关的化学转糖基化问题)。然而,与使用酶相关的操作并发症是该方法的缺点。[18]
(11)
实验条件和程序
典型条件
用于SHJ反应的糖衍生物应在使用前进行纯化,干燥和粉化。已经观察到在路易斯酸存在下苯甲酸酯的芳环在2-乙酰氧基核糖的2-位上的分子内Friedel-Crafts反应,并且代表潜在的副反应。[19]杂环化合物不能太碱性,以避免与路易斯酸过度络合; 在SHJ条件下,氨基取代的杂环如胞嘧啶,腺嘌呤和鸟嘌呤反应缓慢或根本不反应(尽管它们的N-乙酰化衍生物反应更快)。
甲硅烷基化通常使用HMDS完成,其使氨作为甲硅烷基化的唯一副产物。催化或化学计量[20]量的酸性添加剂如三甲基甲硅烷基氯加速甲硅烷基化; 当使用这种添加剂时,铵盐将作为混浊杂质出现在反应中。
路易斯酸应在使用前立即蒸馏,以获得最佳效果。很少需要超过约1.2-1.4当量的路易斯酸。乙腈是这些反应中最常用的溶剂,尽管其他极性溶剂也很常见。使用TMSOTf的反应的后处理涉及用冰冷的碳酸氢钠溶液处理并提取所得的钠盐。当氯化锡(IV)用于1,2-二氯乙烷时,后处理包括加入吡啶并过滤所得的吡啶 - 锡络合物,然后用碳酸氢钠水溶液萃取。[21]
示例程序[22]
(12)
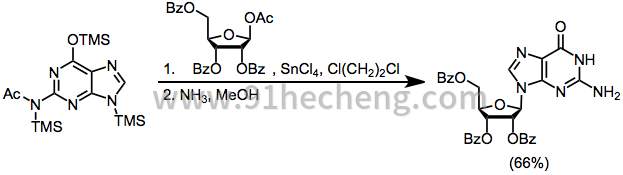
向搅拌的13.5mL(4.09mmol)0.303N甲硅烷基化的N 2 -乙酰基鸟嘌呤在1,2-二氯乙烷中的标准溶液和1.86g(3.7mmol)苯甲酸酯保护的1-乙酰氧基核酸在35mL 1中的混合物中搅拌向2-二氯乙烷中加入6.32mL(4.46mmol)0.705N TMSOTf标准溶液的1,2-二氯乙烷溶液。将反应混合物加热回流1.5-4小时,然后用CH 2 Cl 2稀释。在用冰冷的NaHCO 3溶液处理后,得到2.32g粗产物,将其在24℃下在125mL甲醇氨中保持42小时。处理后,用H 2 O 重结晶,在两批中得到0.69g(66%)纯的鸟苷,其均匀(R f)0.3)在分区系统Ñ丁醇:乙酸:H 2 O(5:1:4),其1 H NMR谱在400MHz下,在d 2 ö仅表现不期望的N个迹线7鸟苷的端基异构体。1 H NMR(CDCl 3):δ3.55,3.63,3.90,4.11,4.43,5.10,5.20,5.45,5.72,6.52,7.97,10.75。


目前评论: