- A+
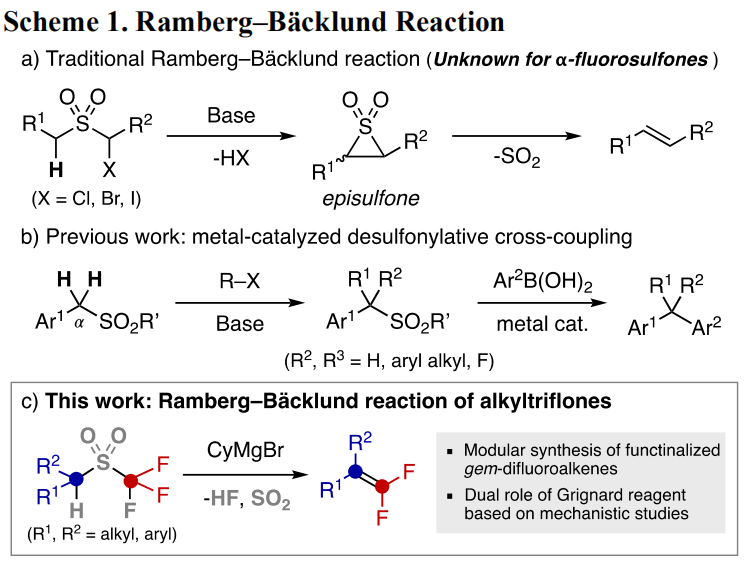
在有机合成中,Ramberg–Bäcklund反应是由α-卤代烷基砜制备官能团化烯烃的常用方法(Scheme 1),在许多天然产物及药物合成中得到的广泛应用。SO2基团具有两个作用:首先可以增加邻位C-H键的酸性,其次可以作为离去基团。尽管这类反应及氟代化合物具有极大的重要性,α-氟代烷基砜参与的此类反应至今没有报道,这可能是由于氟负离子离去能力较差导致的。
在偶联反应中,砜类化合物的重要性与日俱增,由于二氟烯烃在药物化学中有着重要应用,通过这类化合物合成二氟烯烃吸引了化学家的广泛兴趣。虽然Hu课题组可以采用重氮化合物合成全取代的二氟烯烃,但仍旧缺少直接和模块化的方法来合成这类化合物。最近,加拿大女王大学化学系的Cathleen M. Crudden课题组首次采用烷基砜化合物,通过Ramberg–Bäcklund反应合成了一系列偕位二氟烯烃。值得一提的是,反应中采用的格氏试剂不仅可以作为碱,还可以活化C-F键。相关研究成果发表在J. Am. Chem. Soc.上(DOI: 10.1021/jacs.0c07924)。
(来源:J. Am. Chem. Soc.)
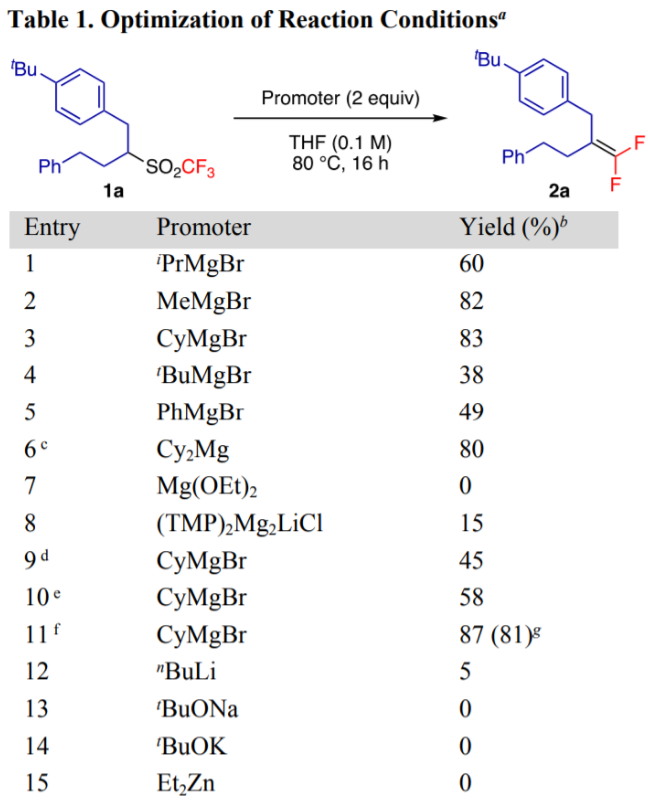
首先,作者采用二级烷基砜1a作为模板底物进行条件优化(Table 1)。通过对碱(包括各类格氏试剂)、温度、反应浓度等反应条件的优化,作者确定的最优反应条件为:2倍量的CyMgBr为碱,THF为反应溶剂,底物于80 ℃下反应16 h,最终可以81%的分离收率得到目标产物。
(来源:J. Am. Chem. Soc.)
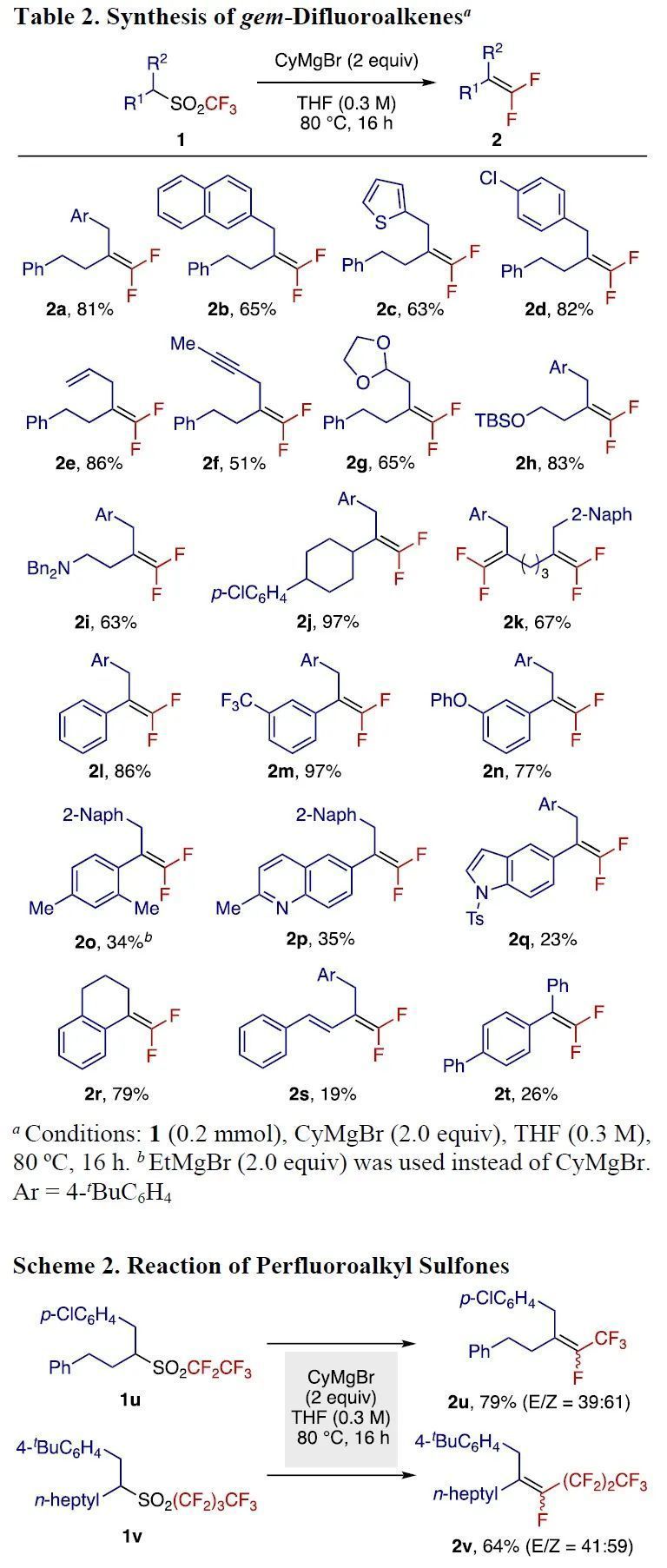
确定最优条件后,作者随后对反应的底物范围进行了扩展(Table 2)。Cl、烯烃、炔烃、氨基等官能团均能兼容反应体系,喹啉、吲哚等杂环也不会影响反应效率。另外,通过这个反应也可以得到共轭的二氟烯烃。值得一提的是,采用多氟烷基砜作为底物,也可以得到相应产物,这是传统方法难以实现的过程(Scheme 2)。
(来源:J. Am. Chem. Soc.)
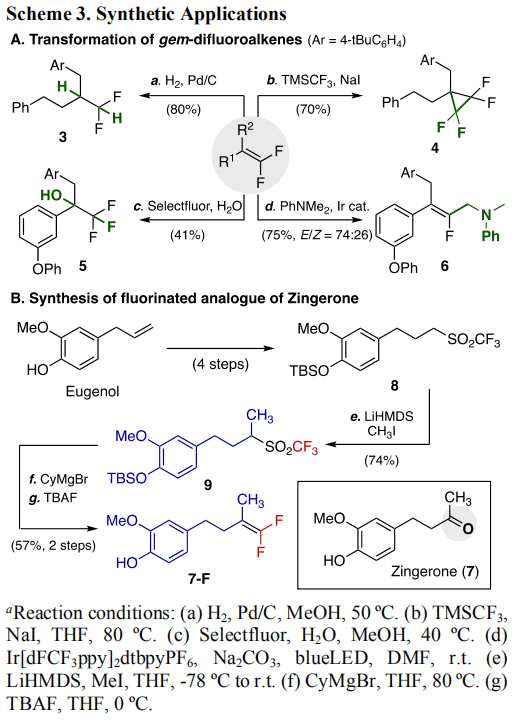
为了说明反应的实用性,作者对产物进行了后续转化(Scheme 3),包括:1)氢化还原双键;2)在TMSCF3/NaI体系中得到四氟取代的环丙烷;3)合成得到三氟甲基取代的三级醇;4)合成四取代单氟烯烃。由于二氟烯烃可以作为羰基的生物电子等排体,作者随后采用这个方法合成了生物活性分子Zingerone的氟代类似物。
(来源:J. Am. Chem. Soc.)
最后,作者对反应机理进行了初步研究,通过分子交叉实验验证了该反应为分子内反应,并通过DFT计算发现Mg-F键可能是反应的驱动力。通过Mg离子与Li离子的对比,作者发现Mg离子对于反应的顺利进行至关重要,这在之前的Ramberg–Bäcklund反应研究中是没有得到关注的。
小结:Cathleen M. Crudden课题组发展了一种新型的二氟烯烃的制备方法,反应采用烷基三氟甲基砜作为底物,为二氟烯烃的制备提供了一种新型的模块化方法。通过后期机理及计算研究,作者发现Mg离子在反应中可以活化C-F键从而促进反应进行,具有至关重要的作用。


目前评论: